
楊鈞堯 (Cyrus Yang)
現職:台寶生醫 TaiwanBio 營運長
學歷:牛津大學分子與細胞醫療博士、
英國倫敦帝國學院碩士、陽明大學學士。
前言
從實驗室到病床邊 “from Bench to Bedside" 是許多生物醫學研究者的目標,然而先端的科學研究到實際的臨床應用之間仍存在著許多不同的挑戰。近年承襲高科技半導體的產業概念,醫藥領域也逐步走向專業分工發展,將開發與製造兩階段外包給專業公司負責。在此氛圍下催生出委託開發暨製造服務 (Contract Development and Manufacturing Organization, CDMO) 的熱潮,歐美乃至亞洲都有許多大型企業投入此一蓬勃成長的市場,如何從競爭激烈的環境中找到適合的發展方向,便是企業方的一個重要課題。這次我們很榮幸邀請到台寶生醫的楊鈞堯營運長與我們對談,分享台寶生醫從細胞新藥開發到 CDMO 獨特的雙軌經營策略與經驗,也提供我們企業方對於人才培育的觀點。
Part 1:台寶生醫的成立與業務發展
JTBA:非常感謝今天楊營運長撥空參與訪談,首先可以請您先為我們介紹一下台寶生醫是個怎樣的公司嗎?
楊營運長:這就讓我先從台寶生醫的歷史開始說起,台寶生醫成立於 2014 年,技轉自陽明大學和台北榮民總醫院開發的低氧、低密度異體骨髓間葉幹細胞 (MSC) 培養技術開發新藥。目前作為已進入臨床階段的再生醫學公司,專注於新一代非癌症領域的細胞醫療開發,並透過專利技術平台,能安全有效的進行基因修飾以提供較傳統細胞醫療更有效的細胞醫療產品。近年來,除了新藥開發的本業之外,因台寶生醫擁有台灣細胞醫療領域最大規模之 GMP 產線,並以此發展 CDMO 委託開發製造服務之業務,以獨樹一幟的商業策略,於市場規模不大的台灣企業中嶄露頭角,拓展國際市場。
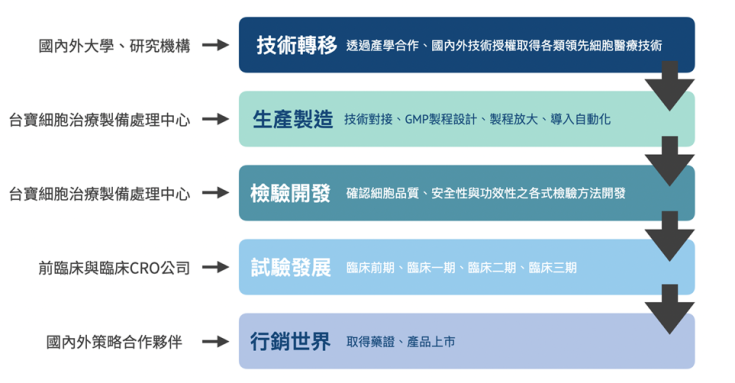
Part 2:細胞新藥開發所面臨的挑戰及解決策略
JTBA:關於細胞醫療產品方面,台寶生醫目前開發中的細胞醫療產品有哪些呢?
楊營運長:台寶生醫以低氧 (Hypoxia)、低密度培養的方式延緩 MSC 的老化 (Senescence),並增加其離體培養的分裂次數,簡而言之就是開發出了一種可以量產 MSC 的技術。並且以這套 MSC 量產技術為底,台寶目前已有開發兩項新藥進入臨床二期試驗,一是治療膝部退化性關節炎的新藥 Chondrochymal®,二是治療糖尿病足造成的不癒合傷口新藥 Biochymal®。
JTBA:在開發細胞醫療產品時會面臨什麼樣的挑戰?台寶生醫又是以何種策略迎戰?
楊營運長:
[現有的技術與設備]
問題:雖然有量產 MSC 的技術作為藥物開發的後盾,不過這並不意謂著成本跟著降低;低氧培養下,MSC 生長的比較緩慢,因此消耗的培養液非常大量,尤其是當要符合 GMP 規格的培養液,那可是相當昂貴。除此之外,訓練 GMP 規格的實驗操作員是也是相當大的時間成本。
🡪 解決策略:培養液等細胞培養的耗材不太容易取代或替換,因此強化單位 MSC 的功能成為壓低成本的方式。台寶與許多國際知名大專院校研究機構共同開發技術,像是推出航母級載體平台,使單位 MSC 具有更好的效果。關於人力成本之問題,台寶導入自動化設備,不僅降低對人力的需求,也提升了品質管控,達成更高的良率。
[市場規模的考量]
問題:新藥公司若只單純面向國內市場很難生存下去,且 MSC 新藥其實不是多新穎的概念,國外也已經有類似的產品。如果仰賴開發已有成功案例的 me-too 產品,雖然風險較低,但面向國際市場則會落後其他廠,起步晚將難以競爭。
🡪 解決策略:有別於國際各廠的新藥都是靶向癌症領域,台寶生醫將 MSC 新藥開發著重於非癌症領域,像是自體免疫疾病或炎症疾病等,以爭取國際市場。
[專利申請]
問題:自然衍生物是無法申請專利,MSC 只是從骨髓內分離出來的幹細胞,屬於自然衍生物的範疇,並無法針對 MSC 藥物本身申請專利保護,只能針對細胞的操作做專利申請,例如 CAR-T 的載體設計。
🡪 解決策略:台寶選擇避開已經競爭激烈的 CAR-T 癌症治療領域,轉以基因修飾的細胞醫療著手。針對具有明確作用機制的產品技術開發,便可針對此部分進行專利保護。台寶首先從過去較熟悉的 MSC 開發相關基因修飾技術,再將此模式應用到其他免疫細胞類型,開發新的細胞治療產品。同時與美國的知名院校、醫院和公司方合作,共同開發/技轉專利技術。
JTBA:細胞治療新藥就必須考慮到自體 (autologous) 或異體 (allogeneic) 的問題,但感覺自體能使用的消費者就不多,異體目前又存在許多未克服的問題,幾乎不可能做到,台寶是以甚麼樣的策略在發展細胞新藥?
楊營運長:在業界有個笑話叫做「做 Autologous 的公司,沒有去過商學院;做 Allogeneic 的公司,沒有念過醫學院」。大家都知道 Autologous 在商業模式上的問題,但是免疫系統在長時間的演化之下發展的太好了,克服排斥這件事情在現階段絕對不容易達到。我們都知道 MHC 對於自我、非我的辨識極為重要,理論上用基因編輯的方式剔除 MHC 分子即可做出 universal 的細胞。但 MHC 對於細胞的生理也扮演著重要的角色,剔除 MHC 的細胞沒有辦法維持細胞本身該有的功能,至少現階段不容易做到。不過可以退而求其次,利用 Super donor*註1 的 MSC 來開發藥物的話,可以使用的人還是有機會增加。儘管如此,一支藥物動輒百萬千萬,一般人也很難負擔得起。不過,細胞新藥的客戶,買家通常都不直接是病人個體,而是國家保險或是私人保險。保險公司有其計算的方式,如分析疾病發生率對應藥物療法的花費金額,商業經濟上可行,便有機會讓昂貴的藥物給病人使用的到。
Part 3:CDMO 業務開始之契機及獨樹一幟的商業策略 — 大 D 小 M
JTBA:提到 CDMO,我們對這個業界並不是很熟悉,可以請楊營運長稍微跟我們解說一下 CDMO 是什麼?台寶生醫又為什麼會開啟這項業務?
楊營運長:開啟 CDMO 的契機其實相當簡單,那就是閒置的 GMP 廠本身就是一個很大的成本,GMP 廠的維護費用是相當驚人的。為了要讓這些 GMP 廠動起來,接製造的單,協助生技公司新藥開發的製程導入 GMP 的規格,便成為了一條出路。
* 在開始提到台寶的 CDMO 策略之前,我們應該先來提一下何謂 CDMO 及 CMO。
CDMO 全名 Contract Development Manufacturing Organization,CMO 全名 Contract Manufacturing Organization。他的概念其實沒有那麼複雜,若有生技製藥公司研發了一支新藥,為了進到下一步的臨床試驗,導入 GMP (Good Manufacturing Practice 優良製造規範) 的概念是不可或缺的。但是 GMP 產線、設備、規範及流程都是相當複雜,為了加速這一過程,CMO 就會協助將產品導入 GMP 進行生產製造,而 CDMO 不僅僅只是將產品導入 GMP,還會在導入的過程中優化其製程 (Development 的概念在這),甚至是協助導向自動化生產。
大部分的 CDMO 廠商是不接觸產品過於早期 (early stage) 的客戶,在產品製程還不成熟的情況下,不太有廠商會願意從產品的初期開始優化製程,進而導入 GMP。但有別於大部分的 CDMO 廠商,台寶的「大 D 小 M 」策略就是專注於新創產業的早期開發 (Development),在產品製程的早期就開始導入 GMP 概念,使其製程從最初開始就符合 GMP 規定,與新創企業一起成長,以利後來的 GMP 等級產品的量產,及後面第 1/2/3 期臨床試驗的合作案。
近期在美國及日本也開始有成立像台寶一樣的 early stage CDMO 公司,例如美國的 Kincell Bio 及日本的 CytoFacto,也足夠證明台寶的策略有多成功。
JTBA:台寶生醫 CDMO 業務的第一步怎麼跨出去的,客戶怎麼來的?
楊營運長:其實一開始,也是找身邊業界的朋友,先試試看這樣的商業模型可不可行。在把身邊的朋友走過一輪,並獲得成功的經驗之後,開始進一步往外拓展。其實台灣的市場還是偏小,我們大部分都還是在國際上找客戶,透過一些我們有合作的學校和醫院,像是透過哈佛大學去接觸當地的新創公司。接下來是有實績之後,真正的把客戶產品成功推到 IND*註2 (Investigational New Drug 試驗用新藥) 階段,就會漸漸開始有口耳相傳的介紹了。
JTBA:台寶生醫目前有日本的客戶嗎?
楊營運長:台寶生醫目前的日本客戶相對比較少,其實有兩個原因,但目前還不容易解決。第一是日本的 GMP 法規跟別人的不太一樣,儘管邏輯跟歐美是一樣的,但是條文內容,寫得很難讓人理解,即便有日文的翻譯,還是覺得有模糊的地帶。第二個是日本的商業文化,當日本人在談生意的時候,好像很難從他的回答聽出他是拒絕還是接受。另外補充說明,基本上 GMP,全球就兩大系統,美國的 21 CFR (Code of Federal Regulations) 及歐洲的 PIC/S (Pharmaceutical Inspection Co-operation Scheme 國際醫藥品稽查協約組織) GMP。台灣是 PIC/S 的會員,日本則是不在這兩個規範之內。
Part 4:企業人才培育與對不同學經歷人才的期望
JTBA:學生時代有機會接觸到 GMP 的概念嗎?
楊營運長:在學校大概率是學不到的。為什麼這樣說呢,因為細胞治療這領域相對新,法規單位對於規範的制定也需與時俱進。如果想要早點接觸 GMP 概念的話,建議透過企業實習,了解前線工作的真實情況,會比較容易接觸到。
JTBA:想知道台寶生醫的人才育成制度及企業實習的具體目標及內容?
楊營運長:台寶生醫除了研發單位之外,還有很多部門,我們一開始會先跟你聊你比較想去哪個部門。除了會針對每個部門做說明之外,一開始還會有現地導覽,看看工廠/研發中心後,再進一步的面談興趣/個性,最後建議到哪個部門去。基本上台寶的實習不會打高空,而是真實到公司內共同完成一個小 project,實際上讓你了解未來進到公司之後會受到怎樣的 training。台寶也有個設施叫做 pilot CPU (Cell Processing Unit 細胞製備場所)。他可以讓學員不用穿上無塵衣,不用受過專業的 GMP 訓練,我們也能手把手的教你,也能體驗 GMP 設備,更加實際的了解到個 SOP 的意義及每一段的 QC 檢驗及其目的。
JTBA:聽起來實習主要還是以線下為主,有沒有針對像我們一樣的日本留學生有配套的實習方案呢?
楊營運長:實際到台灣參加還是會比較好。GMP 它有一個很重要的概念是它是一個系統也是一個思考邏輯,但它更是一個場域,所以有時候你沒有到現場你其實很難體會為什麼會在這個地方設計管控點。但當你來到現場,你就會發現這個地方如果不管控會造成什麼樣的問題。所以會建議你們暑假或者相對長的假日過來,具體的實習合作方案,可以再請 JTBA 提出適合日本留學生的實習 program,我們再來深入討論。
JTBA:台寶生醫有沒有傾向招募碩士或博士畢業的員工?
楊營運長:我們對碩博士的期待當然會不同,然後有些部門其實也不需要博士,比如說製造,所有製造都得符合 SOP,基本上能改的地方就會很少,所以如果博士看到製程就想要 optimize,那反而是 GMP 裡面最怕的事情。但像是 BD (Business Development 商業開發) 部門,我們就會期望博士要能夠獨立領導專案,碩士要有足夠的知識去參與專案,所以並沒有特別說傾向招募哪種學位的人才,但我們對招募來的人才肯定是會有對他的期待。
JTBA:台寶生醫有沒有對日本畢業的人才有所期待?
楊營運長:我們是間很國際化的公司,對我來說,人才從甚麼地方來我不是那麼在意,我們當然會要求你要有基本的英文程度,因為我們很多時候都是接觸國外的客戶,會需要你能夠用英文簡報。會日文當然額外加分,當接觸到日本客戶的時候,這時你就可以做很多事,也像我前面所提到的,我聽不懂他字裡行間外的意思,若你能了解就很加分。所以,基本上哪邊畢業真的還好,程度才是我們比較在乎的。
結語
JTBA:最後,能請營運長為此次訪談做一個結語嗎?
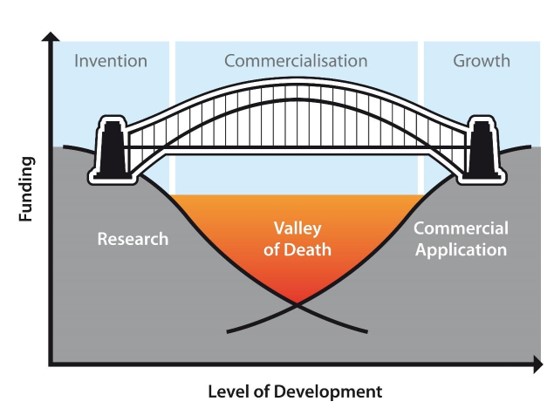
楊營運長:相信大部分的人都看過死亡谷 (Valley of Death) 的圖片,基礎研究到商業應用的過程中,存活率通常都不超過 10%,造成死亡谷很大的原因之一是因為法規的規範。台寶生醫之所以在新藥開發及 CDMO 的事業中能夠走出獨特的道路,理由就是因為台寶生醫曾經親身走過死亡谷。因此能將自己的經驗轉化為成功的商業模式,同時也藉此幫助新創公司建立一座跨越死亡谷的橋樑,與客戶共同成長。
(圖片來源:Gemaker)
- 註1 Super donor:超級捐贈者,通常為 HLA 同型合子,可以提供多數人滿足半吻合捐贈。(Yoshida et al., Med 2023 https://doi.org/10.1016/j.medj.2022.10.003)
- 註2 IND: Investigational New Drug 的縮寫,通過審查可以進入 Phase 1 臨床試驗的藥物。(Investigational New Drug Definition | Law Insider)
採訪|丘幃尹 (京都大學 醫學研究科 醫科學專攻 博士班)
藍冠鈞 (京都大學 醫學研究科 醫學專攻 博士班)
陳蓉 (京都大學 醫學研究科 醫科學專攻 碩士班)
陳佩妮 (京都大學 理學部 生物科學系 學士班)
撰稿|丘幃尹
審稿|楊鈞堯 營運長、藍冠鈞、陳蓉









發表留言